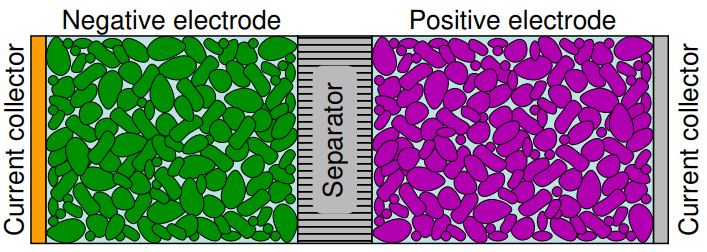
전기화학 전지는 크게 음극, 양극, 분리막, 전해질, 집전장치 5개로 구성되어 있습니다.
이번 글은 각각에 대한 기능과 충 방전에서 일어나는 과정들에 대해서 적어보도록 하겠습니다.

1. Negative Electrode (음극)
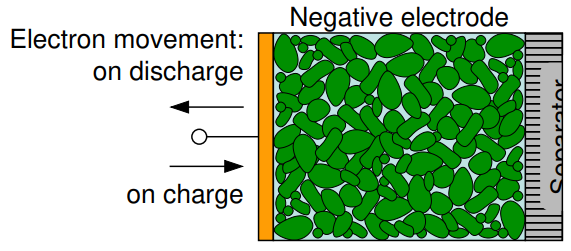
음극의 구성은 주로 금속 또는 합금, 수소 (Lead Metal or paste for PbA)로 구성됩니다.
방전 과정 동안에는 음극 쪽에서는 산화(Oxidation) 과정이 일어나면서 가지고 있던 전자를 외부 회로로 주게 됩니다. 이때 음극을 애노드 (Anode) : "전자를 방출하거나 산화(Oxidation) 반응이 일어나는 전극"라고 부르게 됩니다.
(OIL : Oxidation is Loss of electrons)
충전 과정 동안에는 전자를 외부 회로로 부터 받게 되며 이때 환원(Reduction) 과정이 일어납니다.
이때 음극을 캐소드 (Cathode) : "전자가 들어오거나 환원(reduction) 반응이 일어나는 전극"라고 부르게 됩니다.
(RIG : Reduction is Gain of electrons)
2. Positive Electrode (양극)
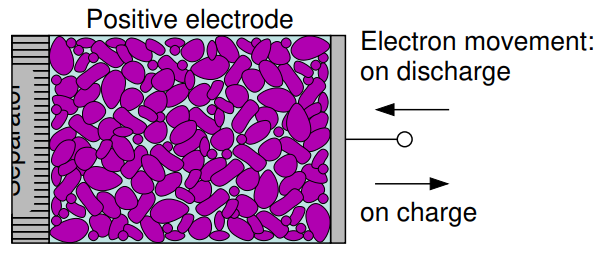
양극의 구성은 주로 금속 산화물, 황화 수소 (Sulfide) 또는 산소 (Lead oxide for PbA)로 구성됩니다.
방전 과정 동안 음극에서 나와서 외부 회로를 통해 이동해온 전자를 받는 과정, 즉 환원(Reduction) 과정을 진행하게 됩니다. 마찬가지로 방전 과정에서의 양극을 Cathode로 칭합니다.
충전 과정 동안에는 양극에서 외부회로로 전자를 내보내며 산화(Oxidization) 과정을 진행하게 됩니다. 산화과정이 일어나고 있는 양극을 Anode라고 부르게 됩니다.
3. Electrolyte (전해질)
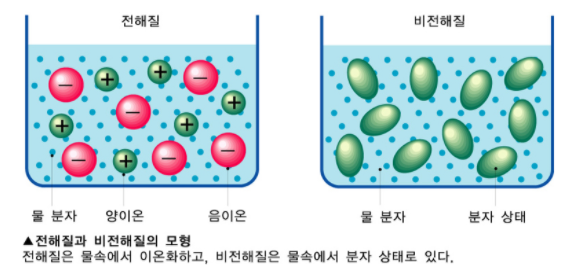
전해질은 수용액 상태에서 이온으로 쪼개져 전류가 흐르는 물질입니다. 또한 전해질은 전극 사이에서 이온들의 이동에 대해서 매개체 역할을 수행하며 소금이나 산 등의 이온 전도도 (Ionic Conductivity)를 제공하는 물질로 구성되어있습니다.
 |
 |
여기서 양이온은 [+] 전기를 띤 이온을 의미하며 음이온은 [-] 전기를 띤 이온을 의미합니다. 중성인 원자가 전자를 잃게 되면서 양전 자수가 과잉 상태가 된 것을 양이온(Cation)이라고 하며, 반대로 전자를 얻게 되어 음전 하수가 과잉 상태가 된 것을 음이온(Anion)이라고 합니다.
4. Separator (분리막) & Current Collector (집전 장치)

분리막(Separator)은 전해액과 분리막은 배터리의 안전성을 결정짓는 구성요소로써 전기적으로 양극과 음극의 접촉을 막아주는, 절연하는(isolate) 역할과 Cell의 자가 방전을 막기 위해서 존재합니다. 종종 유리나 섬유 또는 폴리에틸렌과 같은 고분자로 구성되며 전자가 전해액을 통해 직접 흐르지 않도록 하고, 내부의 미세한 구멍을 통해 원하는 이온만 이동할 수 있게 만듭니다.
전류 집 전장치 (Current Collector)는 양극과 음극에서 전자를 외부로 전달하기 위해 사용되며 전극의 전체 골격을 유지하는 기능도 합니다.
* 보편적으로 화학 전지에 사용되는 구성 요소들
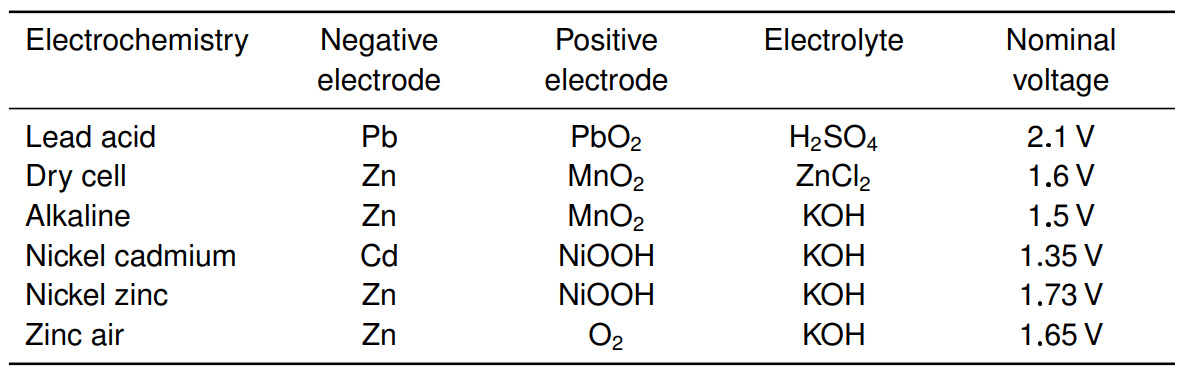
기본적으로 전기 화학 전지는 Cell에 전기 에너지를 저장합니다. 즉 구체적으로는 Electrochmical Potential Energy로써 전기화학 잠재적 에너지를 저장하고 또는 내보내는 것입니다. 기본적으로 전기 화학 전지는 Cell에 전기 에너지를 저장합니다. 즉 구체적으로는 Electrochmical Potential Energy로써 전기화학 잠재적 에너지를 저장하고 있으며 전기적인 에너지로 내보내어 일을 수행하도록 하는 것입니다.
방전 과정
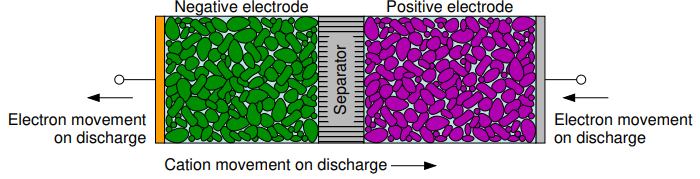
음극에서의 Electrochemical Potential Energy는 전자를 외부 회로로 내보내며 양이온(Cation)이 전해질로 들어가는 화학반응을 선호합니다.
반대로 양극에서는 Electrochemical Potential Energy는 외부 회로로부터 오는 전자와 전해질을 통해 오는 양이온을 받는 과정을 선호합니다.
여기서 전기적 Potential 차이가 Terminal에서 발생하게 되는데 이 차이가 바로 Cell Voltage 가 되겠습니다.
충전 과정 (2차 전지에 해당 - Secondary cells)
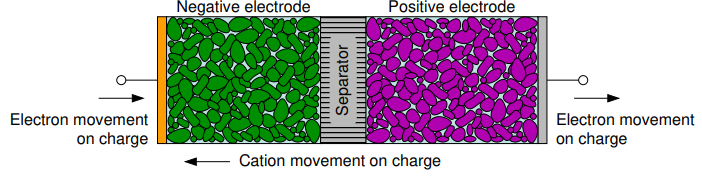
충전 과정을 진행하면서 양이온(Cation)은 양에서 음극으로 전해질을 통해 이동하게 됩니다. 또한 전하도 양에서 음극으로 외부 회로를 통해서 이동하게 됩니다. 충전 과정 동안에 에너지가 Cell 내부로 들어오게 되며 다시 활성 화학물로 돌아오게 됩니다.
Reference : Introduction to battery-management systems ( Coursera Lec 1.1.3~1.1.4 )
'전공 관련 (Major) > 강의 (Lecture)' 카테고리의 다른 글
| 6. Battery Management System 구성 및 기능들 (2) | 2021.01.15 |
|---|---|
| 5. Battery Management System의 5가지 조건 (2) | 2021.01.14 |
| 1. 배터리 관련 개념 및 용어 정리 (0) | 2021.01.10 |
| 3. 전기화학 관련 용어 정리 (0) | 2021.01.10 |
| 4. 리튬 이온 전지란 (구성, 장단점, 원리, 재료의 현황) (0) | 2021.01.10 |




댓글