Electrode Potential
electrode potential는 전극의 전위로써 하나의 물질이 전자를 잃거나 얻는 경향을 의미합니다.
* 전위 ( Electric potential ) = 시간에 따라 변하지 않는 전기장에서 단위 전하가 가지게 되는 전기적 위치 에너지.
* 전극 ( Electrode ) = 회로 내의 도체로 전류를 흘러들어 가게 하거나 나오게 하는 단자.
음 전위를 가진 화합물일 경우 음 전극에 사용되며 양 전위를 가진 화합물은 마찬가지로 양 전극에 사용된다. 2개의 전극에서 전극의 전위차가 클수록 더 큰 전압을 Cell에서 발생시킬수있으며 즉 더 큰 에너지를 생산할 수 있습니다. 다만 사용되는 물질들은 자연의 원리에 의해서 움직이기 때문에 우리가 수정할 수는 없습니다.
Periodic Table
Periodic Table은 주기율표 또는 주기표로 원소를 구분하기 쉽게 성질에 따라 배열한 표로써 러시아의 드미트리 멘델레예프가 처음 제안하였습니다.

다음 표에 대해서 설명을 적어보겠습니다.
최 하단의 화살표 : 해당 화살표는 각 원소의 산화 및 환원의 정도를 표현한 것으로 상대적으로 오른쪽으로 갈수록 산화 능력이 좋은 원소로 구성이 되며 왼쪽으로 갈수록 환원 능력이 좋은 원소를 나타냅니다.
| 주기율 표 |
|
 |
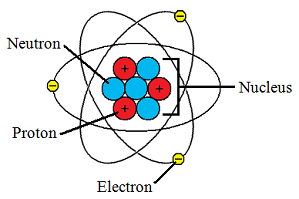 |
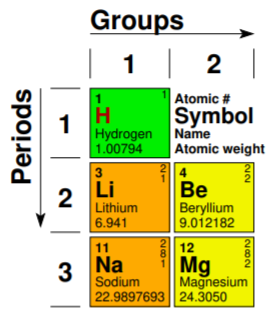
1. 각 칸에의 좌측 상단의 숫자는 원소번호(Atomic Number)입니다. 그리고 해당 원소 번호는 원자 구조(좌측 그림)에서 양성자(Proton)의 개수와 동일합니다.
2. 알파벳은 각 원소의 줄임말 또는 상징(Symbol)으로써 원소번호 하단에 위치합니다. 알파벳은 색에 따라서 분류가 되기도 하는데 해당 원소가 고체, 액체, 기체(방의 온도에 영향을 받음) 즉 원소의 상태에 따라서 다른 색이 칠해집니다.

3. 원소의 풀네임 하단에는 원자의 평균 무게(질량수)가 적혀 있습니다. 보통 원자의 무게는 핵의 양성자 또는 중성자의 개수에 비례하며 번외로 원자의 크기는 전자의 궤적 크기에 영향을 받습니다.
4. 우측 최 상단의 숫자는 전자의 수를 의미하며 각각의 전자껍질이 가진 전자의 개수를 의미합니다. 예를 들어서 나트륨 같은 경우는 3개의 숫자가 적혀져 있는데 제일 안쪽 껍질에는 2개, 그다음 껍질에는 8개, 최외각에는 1개의 전자를 가지고 있습니다.
* 여기서 전자껍질의 의미는 원소를 구성하는 최외각 전자가 돌면서 만드는 궤적을 의미하며 원자가 껍질(Valence Shell)이라고 합니다. 원자가 껍질 (Valence Shell)에 속한 전자를 원자가 전자(Valence Electrons)라고 하며 화학반응에서 가장 중요한 역할을 수행합니다.
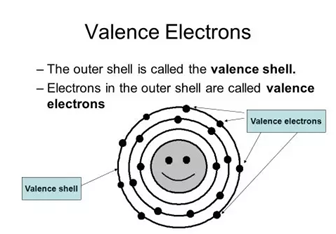
만약 원자가 껍질에 전자가 없는 경우를 불활성(화학적 상호작용에 관여하지 않음) 기체(inert)라고 하며 대신 부 껍질에 전자가 채워져서 안정된 상태를 이루는 상태를 말합니다.
* 원자가 전자와 최외각 전자의 차이점
최외각 전자는 가장 바깥 껍질에 존재하는 전자를 의미하며 원자가 전자는 전자 배치에서 가장 바깥 궤도에 존재하며 결합에 관여하는 전자를 말합니다. 1~17족까지는 최외각 전자 수와 원자가 수가 동일하지만 18족인 비활성 기체의 경우에는 가장 바깥 껍질에 존재하는 전자 수가 8개이지만, 결합에 관여하는 전자는 없기에 전자 수는 0이라고 합니다.
* Valence : 원자가라고 하며 한 개의 원자가 다른 원자들과 어느 정도 수준으로 공유 결합이 가능한지를 나타내는 척도입니다. 예로써 탄소의 원자가는 4, 수소의 원자가는 1입니다.
5. 각 칸들의 색상은 원소가 금속이냐 아니면 비금속인가를 나타냅니다.

6. 주기율표의 열(Row)은 주기(Period)를 의미합니다.
주기의 수는 전자의 껍질수를 의미하며 같은 행에 있는 원소들은 모두 같은 수의 원자 껍질을 가지고 있습니다.
7. 주기율표의 행(Columns)은 그룹(Group)을 나타냅니다.
동일한 Group안에 속한 원소들은 최외각 껍질(Valence shell)에 동일한 원자가 전자 (Valence Electrons) 수를 보유합니다. 다만 전이 금속 (Transition metal)은 제외됩니다.
Electrochemical Series
원자의 에너지 준위는 전자를 얻거나 잃으면서 변화합니다. 즉 방전이 될 때는 에너지가 전기에너지로 나가며 2차 전지의 경우 충전할 때는 전기에너지가 들어오게 됩니다. 반응 이후의 전기적 포텐셜 에너지의 차이는 전압의 차이로 측정이 가능합니다. 해당 전압의 차이는 Electrochemical Series에 각 원소가 가진 전위가 기록되어 있습니다.
Electrochemical Series는 ‘표준 전극 전위 표’라고도 하며 금속 원소 또는 이온들이 얼마나 쉽게 전자를 잃을 수 있는지, 또는 전자를 얼마나 쉽게 받아들일 수 있는지를 표시한 리스트 또는 테이블입니다. 수소는 표준 전극 전위가 0으로써 다른 물질들의 전위를 나타낼 때 기준이 되는 값이 됩니다.
표준 전극 전위가 더 높은 +값일수록 수소이온보다 전자를 받아 환원되기 쉬운 것이며 상대적으로 강한 산화제입니다. 반대로 표준 전극 전위가 더 낮은 -값일수록 수소이온보다 환원되기 어려운 것을 의미하며 이때를 상대적으로 강한 환원제라고 말할 수 있습니다.
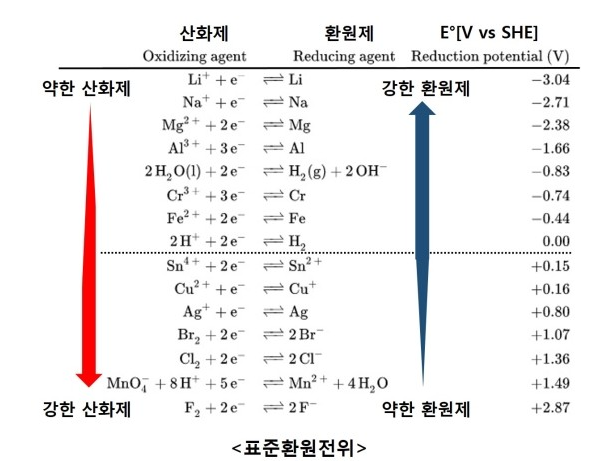

여기서 우리가 흥미를 가지는 물질은 바로 리튬인데 리튬은 최 하단에 위치하고 있습니다. 현존하는 원소 중에서 가볍고 작은 크기이면서 높은 효율을 낼 수 있는 것은 리튬뿐으로 매우 강한 환원제의 역할을 할 수 있는 것입니다.
옥텟 규칙 (octet rule)
옥텟 규칙 : 분자를 이루는 각각의 원자는 전자가 최외각 껍질에 8개가 들어갔을 때 가장 안정적인 상태라고 하는 화학 이론.
( 8개를 가진 원소, 헬륨 또는 아르곤 같은 원소들은 안정한 상태이므로 결합을 하지 않으려 함 )
예를 들어 1족 원소인 Na(나트륨) 같은 경우 최외각 껍질에 전자의 수는 1개입니다. 그리고 중간의 껍질에는 8개가 있는데 나트륨이 안정적인 상태가 되려고 하면 최외각 전자 1개를 버림으로써 안정적인 상태가 될 수 있는 것입니다.때문에 Na+는 Ne과 동일한 전자 배치를 형성할 수 있습니다.

2족 원소인 Mg(마그네슘) 같은 경우 최외각 껍질에는 2개를 가지고 있으며 중간 껍질에는 8개를 가지고 있기 때문에 마찬가지로 전자 2개를 버림으로써 안정적인 상태로 될 수 있습니다.
17족 원소인 Cl(염소)는 최외각 전자는 7개를 가지고 있으므로 전자한 개를 얻음으로써 안정적인 상태가 될 수 있습니다. 때문에 Ar(아르곤)과 동일한 전자 배치를 형성할 수 있습니다.
이번 글은 화학 전지 이해를 위한 필요 개념들에 대해서 적어보았습니다. 글 읽어주셔서 감사합니다.
Reference : Introduction to Battery-management Systems ( Coursera Lec 1.1.5 )
'전공 관련 (Major) > 강의 (Lecture)' 카테고리의 다른 글
| 6. Battery Management System 구성 및 기능들 (2) | 2021.01.15 |
|---|---|
| 5. Battery Management System의 5가지 조건 (2) | 2021.01.14 |
| 2.전기화학 전지 구성 및 과정 (0) | 2021.01.10 |
| 1. 배터리 관련 개념 및 용어 정리 (0) | 2021.01.10 |
| 4. 리튬 이온 전지란 (구성, 장단점, 원리, 재료의 현황) (0) | 2021.01.10 |




댓글