
순수한 물질 (Pure Substance)는 화학적 구성이 전체적으로 고정돼있는 상태를 말하며 즉 단일로 구성된 물질을 의미합니다.
이 물질들은 열역학에서 주요하게 다루는 물질들로 이유에 대해서는 순수한 물질일수록 수십 년 동안 연구해온 물질의 특성에 의해서 움직이기 때문에 공업용 기계 같은 정밀한 곳에서도 사람이 쉽게 이용 가능하기 때문입니다. 또한 사실상 지금 우리가 살고 있는 지구를 구성하는 대부분을 차지하는 것도 순수 물질이기 때문입니다. 대표적으로 열역학에서는 물, 공기, 질소 등을 다루며 이들은 에너지를 생산하거나 소모하는 공업용 기계를 작동시킬 때 매우 중요한 역할을 하게 됩니다.
* 공기는 알다시피 수많은 구성물로 이뤄져 있습니다. 그러나 예외적으로 큰 변화를 일이 크지 않으며 화학적 구성이 균일하여 순수 물질로 취급합니다.
물 (Water)
대표적인 순수 물질인 물에 대해서 먼저 알아보겠습니다. 우선 물은 다양한 상변화가 존재합니다. 고체에서 액체로 액체에서 기체로 되는 동안 많은 변화를 하게 됩니다. 그러나 열역학에서는 물의 상태변화에 대해서 더 세밀하게 분류하게 됩니다.

- Compressed liquid (Subcooled liquid) : 압축액 ( 열을 가해도 쉽게 기체 상태로 증발하지 않는 상태 )
- Saturated Mixture (Saturated liquid) : 포화액 ( 열을 가하면 온도 상승이 없는 액체 )
- Saturated Vapor : 포화 증기 ( 액체가 증기로 변하는 지점의 증기 )
- Saturated liquid-vapor mixture : 액체와 증기 상태가 평형을 이루며 공존하는 상태
- Superheated Vapor : 과열증기 ( 증기가 더 이상 응축하지 않는 상태입니다. )
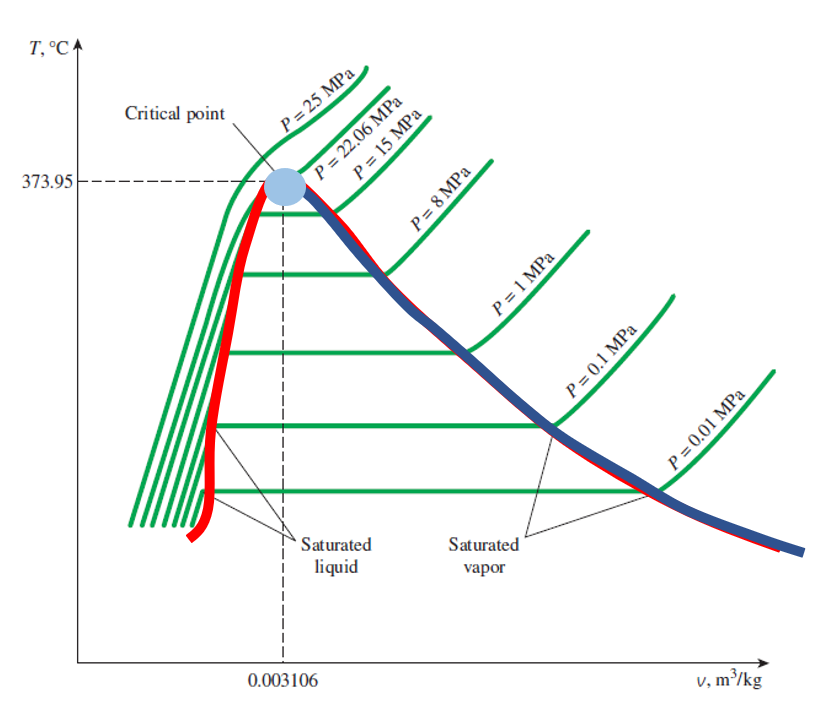
그래프로 표현하면 다음과 같습니다. ( 체적, 온도 v-t 그래프에서 P=1 atm 상태에서의 각각의 상태를 나타내었습니다 )

여기서 궁금한 것이 있습니다 도대체 포화란 개념은 무엇일까요. 예를 들어서 밀폐된 용기 내에 액체를 담아두면, 처음에는 액체 표면에서는 끊임없이 기체가 증발하는데, 어느 정도 시간이 지나면, 용기 안에 있는 용액은 더 이상 줄지 않는 게 됩니다. 그리고 이상태에서의 액체를 바로 포화액이라 부르게 됩니다.
정리하면 특정 환경에서 액체 표면에서 나가는(증발하는) 분자의 수와 반대로 액체 속으로 녹아드는 기체 분자의 수가 같아져서 외관상 증발도 액화도 일어나지 않는 평형 상태를 바로 포화 상태라고 부르게 됩니다. 여기서 어느 한쪽이 강해지면 압축 상태나 과열 상태가 되는 것이죠.
Saturation Temperature & Saturation Pressure
포화 상태에서의 온도와 압력에 대해서 적어보겠습니다.
우리가 아는 물의 끓는점은 100도입니다. 하지만 1 atm이라는 압력 하에서 100도에서 끓게 됩니다.
그러나 높은 산에서는 압력이 낮습니다. 때문에 밥이 설익게 되는데 즉 끓는점은 압력에 영향을 받게 됩니다.
이때 포화 상태가 되는 온도를 포화 온도 (Saturation Temperature)라고 부르게 됩니다.
일정한 압력에서 순수 물질이 상변화 하는 온도라고 생각하시면 되겠습니다.
그리고 포화 압력 (Saturation Pressure)는 마찬가지로 주어진 온도에서 상변화가 일어나는 압력이라고 생각하시면 되겠습니다.
하단의 표는 고도에 따른 대기압과 끓는 온도에 대한 표입니다.
(1 atm = 101.33 kpa 은 우리가 존재하는 대기압이라고 생각하시면 됩니다.)
 |
 |
상을 변화 시키기 위해서는 에너지가 필요합니다. 얼음의 상태에서 물이 되려면 주위의 열에너지를 얻어서 상을 변화하는 것과 말이죠. 상 변화 시 사용되는 열은 Latent Heat 즉 잠열입니다. ( 저번 포스팅에서 에너지의 종류에 대해 설명할 때 Latent energy를 잠깐 적어 보았습니다. )
- Latent Heat : 상 변화 과정 동안 흡수되거나 방출되는 에너지 양
- Latent Heat of Fusion : 액화 과정에서 흡수되는 에너지의 양, 냉동이 될 때 방출되는 에너지의 양과 동일
- Latent Heat of Vaporization : 증기화 되면서 흡수되는 에너지 양, 응축 과정 진행에 필요한 에너지의 양과 동일
잠열은 상이 변화하는 시점의 온도나 압력에 따라서 필요한 잠열이 달라지게 됩니다.
예를 들어서 1 atm 압력에서 Latent heat of Fusion of water는 333.7KJ/Kg이 되겠습니다.
또한 Latent Heat of Vaporization은 2256.5 KJ/Kg이 되겠습니다.

Property Diagrams for Phase-Change Processes
상변화에 대한 특성들을 공부하기 위해서 수많은 학자분들께서는 옛날부터 각 순수 물질에 대한 특성들을 모두 표기를 해두었습니다. 아마도 열역학 책의 맨뒤를 보시면 Property Table이 있으실 건데 물부터 시작하여 질소 그리고 암모니아까지 다양한 물질에 대해서 온도, 압력, 체적에 따른 Table을 정리해두었습니다.
Property Table에 대해서는 다음 글에서 적어보도록 하겠습니다.
상변화에 대한 특성들을 공부하기 위해서 또 한 가지의 요소는 Property Diagram입니다.
: Property Diagram은 T-v 선도, P-T선도, P-V 선도 등의 순수 물질에 대한 특성을 그래프로 표현한 것입니다.
T(온도) - V(체적) 선도 : 각 라인은 압력선으로써 해당 압력에서의 온도, 체적의 변화를 나타내었습니다.

여기서 구체적으로 설명을 추가한다면 윗 그림에서 빨간색 선을 추가하여 경계선을 만들어보겠습니다.
표의 오른쪽 그림은 왼쪽 그림의 빨간색 라인만 표현한 그림입니다.
 |
 |
여기서 우리가 관찰할 수 있는 점은 수평한 지점과 그리고 상승하는 지점, 그리고 아주 가파르게 상승하는 지점 이렇게 3개로 나눌 수 있습니다. 또한 압력이 높아질수록 점점 수평한 구간이 사라지는 것을 보실 수 있습니다.
각각의 영역들은 앞서 배운 포화액, 포화 증기, 압축액, 과열 증기, Mixture의 지점들과 영역들로 나타낼 수 있으며 압력이 아주 높아질수록 액체와 기체의 경계가 무너진다는 점을 우리가 알 수 있었습니다.
- 빨간색 선 : 포화액 (Saturated liquid)
- 파란색 선 : 포화 증기 (Saturated Vapor)
- 빨간색 선 좌측 영역 : 압축액 영역 (Compressed liquid Region)
- 빨간색, 파란색 중앙 영역 : 포화액 및 포화 증기 영역 (Saturation liquid & vapor Region - Mixed)
- 파란색 선 우측 영역 : 과열 증기 영역 (Superheated Vapor Region)
- 하늘색 점 : Critical Point
여기서 경계가 흐려지는 점 (하늘색 점)을 Critical Point라고 하는데 Critical Point는 바로 포화액과 포화 증기의 상태가 동일하게 되는 지점으로 각 순수 물질들의 Critical Point는 모두 높은 압력에서 관찰됩니다.
* Critical Point : 포화액과 포화 증기의 상태가 동일하게 되는 지점
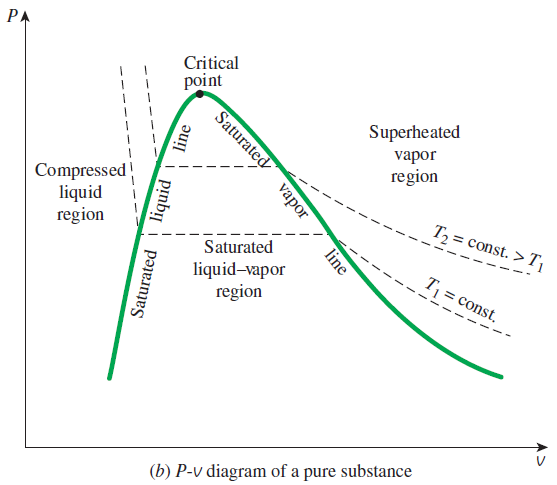
P - V 선도도 마찬가지로 일정한 온도 선을 따라서 다음과 같이 압축액, 포화액, 포화 증기, 과열 증기의 영역을 나눌 수 있습니다.
이상으로 순수물질과 상변화에 대해서 적어보았습니다.
다음에는 엔탈피와 Property Table 그리고 건도 계산과 관련된 주제로 작성해보겠습니다.
읽어주셔서 감사합니다. 피드백은 항상 환영합니다!
'전공 관련 (Major) > 열 역학 (Thermodynamics)' 카테고리의 다른 글
| [열역학] 7. Mass & Energy Analysis of Control Volume 1 (질량 유량,유동일, 유동에너지, 정상상태 유동) (0) | 2021.01.03 |
|---|---|
| [열역학] 6. Properties of Pure Substances 2 (엔탈피, Property Table, 이상기체 방정식 ) (0) | 2020.12.28 |
| [열역학] 4. Energy Transfer & General Energy Analysis (0) | 2020.12.24 |
| [열역학] 3. Heat, Work & 경로, 상태 함수 & 열역학 제 1법칙 (0) | 2020.12.24 |
| [열역학] 2. 기본개념 ( Process & Cycle, Steady State Process, P, T ) (0) | 2020.12.24 |




댓글